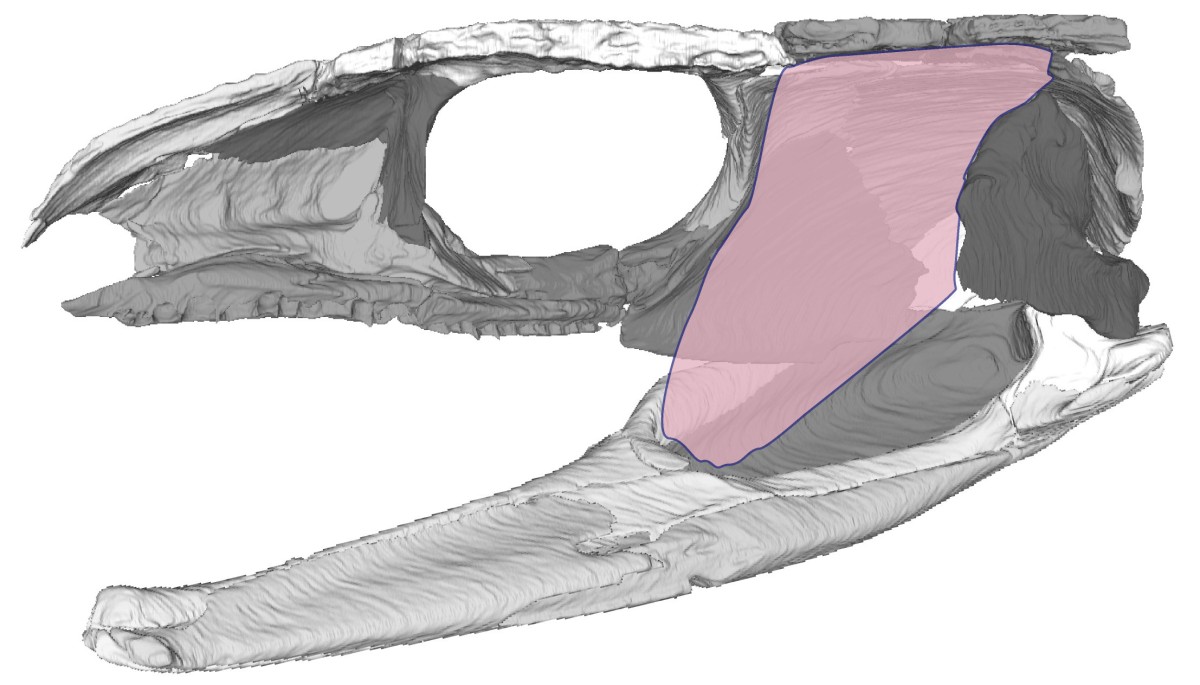
Titelbild: 3D Modell des Schädels von Captorhinus aguti in Innenansicht mit Darstellung der äußeren Kiederadduktoren. Aus Abel & Werneburg (2024).
Im vorherigen Teil haben wir gelernt, dass man bei den Landwirbeltieren (Tetrapoden) verschiedene Schädeltypen findet, die sich anhand der Art und Anzahl sogenannter Schläfenöffnungen unterscheiden lassen. Besonders innerhalb der Amnioten, also der gemeinsamen Gruppe aus Säugetieren, Reptilien und Vögeln, wurden oft ganze Verwandtschafsgruppen anhand ihrer Schläfengestalt definiert. So hätten wir beispielsweise die Gruppe der Anapsida ohne Schläfenöffnungen, die Synapsida mit einem Paar seitlicher Öffnungen oder die Diapsida mit je einem Paar an der Seite und oberhalb der Schläfe. Wir haben aber auch gelernt, dass die Realität deutlich komplexer ist und sich ähnliche Schädeltypen wiederholt unabhängig voneinander entwickelt haben. Doch warum ist das so? Warum sehen wir überhaupt diese Schläfenöffnungen? Und warum variieren sie in Art und Anzahl? Darum geht es hier im zweiten Teil.
Möchte man als PaläontologIn nachvollziehen, wie ein Tier gelebt und seine einzelnen Körperteile funktioniert haben, steht man in der Regel vor dem Problem, dass bei Fossilien 1) viele Teile des Körpers nicht mehr vorhanden sind und 2) sich nichts mehr bewegt. In solchen Fällen ist man darauf angewiesen sich heutige Arten anzusehen um danach, so gut es geht, Rückschlüsse aus den noch erhaltenen Resten längst ausgestorbener Arten zu ziehen.
Bei der konkreten Frage nach der Funktion der Schläfenöffnungen haben wir den Vorteil, dass sie bei den heutigen Tetrapoden (also allen Amphibien, Reptilien, Vögeln und Säugetieren) sehr häufig sind.1 Schädel ohne Schläfenöffnungen sind heute die Ausnahme und selbst dann haben sie sich meistens aus Vorfahren mit Schläfenöffnungen entwickelt.2,3
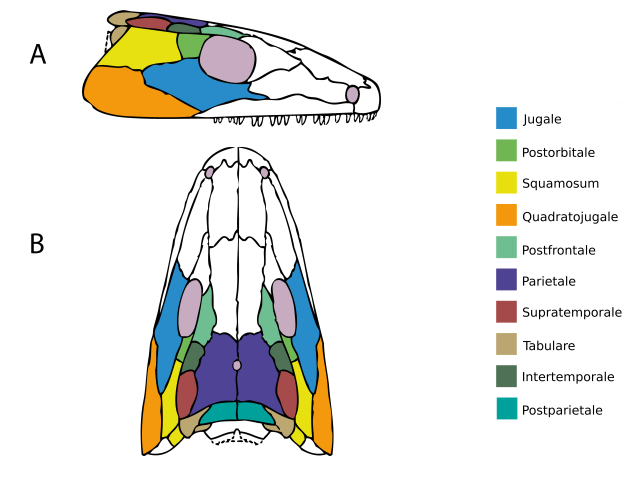
Das war nicht immer so. Die ersten Tetrapoden hatten, bis auf wenige Ausnahmen, keine Öffnungen in ihrer Schläfe. Ihre Schläfe war stattdessen von einem zusammenhängenden Panzer aus Hautknochen bedeckt (Abb. 1). Das erklärt auch, warum manche WissenschaftlerInnen die Gesamtgruppe der Tetrapoden samt dieser Urformen als Stegocephali („Dachschädler“) bezeichnen.4
Erst mit dem Auftreten der Lissamphibia (Froschlurche, Schwanzlurche, Blindwühlen) und Amniota (Reptilien, Vögel, Säugetiere) sehen wir die vermehrte Entwicklung von Öffnungen in diesem Knochenpanzer (Abb. 2). Beim Übergang zu den modernen Tetrapoden muss es also eine Veränderung gegeben haben, für die es vorteilhaft war den „Dachschädel“ hinter sich zu lassen.
Silhouetten (v.o.n.u.) von T. Michael Keesey, Nobu Tamura/T. Michael Keesey (CC BY-SA 3.0), Nobu Tamura (verändert, CC BY-SA 3.0), Dmitry Bogdanov (verändert, CC BY-SA 3.0), Dmitry Bogdanov (verändert), Dmitry Bogdanov (verändert, CC BY-SA 3.0), Nobu Tamura/Andrew A. Farke (CC BY 3.0), Dmitry Bogdanov/T. Michael Keesey (CC BY-SA 3.0), Dmitry Bogdanov/T. Michael Keesey (CC BY-SA 3.0), Dmitry Bogdanov/T. Michael Keesey, Jake Warner, Dmitry Bogdanov (verändert, CC BY SA 3.0), Dmitry Bogdanov/T. Michael Keesey (CC BY 3.0), DataBase Centre for Life Science (verändert, CC BY 4.0), Dmitry Bogdanov/Roberto Díaz Sibaja (CC BY 3.0), Ferran Sayol, Chris Jennings/A. Verriére, Smokeybjb (verändert, CC BY-SA 3.0), Dmitry Bogdanov (verändert, CC BY-SA 3.0), Smokeybjb (verändert, CC BY SA-3.0), Steven Traver.
Die Rolle der Kiefermuskulatur
Hier hilft es sich zu veranschaulichen welche Körperteile sich bei einem lebenden Tier eigentlich in der Schläfenregion befinden. Da wären zum Beispiel die Ohren oder das Kiefergelenk. Tatsächlich wurden beide schon von einzelnen ForscherInnen mit der Schläfengestalt in Verbindung gebracht.5, 6
Insgesamt dürften allerdings andere die Hauptrolle spielen: Die Kieferadduktoren („Kaumuskeln“), also die Muskeln, die für das Schließen des Kiefers verantwortlich sind. Bei uns Säugetieren sind das der Masseter und Temporalis-Muskel (äußere Addukturen), sowie der Pterygoideus medialis (innerer Adduktor). Bei den anderen Tetrapoden haben sie abweichende Namen und Ausprägungen, aber prinzipiell funktionieren sie immer gleich. An ihrem oberen Ende sind diese Muskeln mit den Knochen der Schläfenregion, aber auch mit Knorpeln und dem knöchernen Gaumen verbunden. An ihrem unteren Ende setzen sie an die Innenseite des Unterkiefers an (Abb. 3).

Wie könnten diese Muskeln nun mit der Evolution von Schläfenöffnungen zusammenhängen? Es gab schon früh die Idee, dass Öffnungen im „Dachschädel“ den Kieferaddukturen mehr Bewegungsfreiheit geben würden.7 Und tatsächlich korrelieren große Schläfenöffnungen mit einer entsprechend großen äußeren Kaumuskulatur.8
Aber ist hier wirklich ein ursächlicher Zusammenhang? Vermutlich nicht. Die Idee hängt mit der alten Vorstellung zusammen, dass sich die Muskeln beim Zubeißen „ausbeulen“ würden. Da wäre so eine Öffnung natürlich praktisch. Späte Captorhiniden aber zum Beispiel (vgl. Abb. 3) hatten eine recht breite Schläfenregion und aller Wahrscheinlichkeit nach auch relativ große äußere Kieferadduktoren, allerdings keine Schläfenöffnungen.9 Selbst wenn man von „ausbeulenden“ Muskeln ausgeht, braucht es also ein bisschen mehr um wirklich auch eine Öffnung des Knochenpanzers zu erreichen.
Das Zusammenspiel aus Muskeln und Knochen
Wie hängen denn Muskeln und Knochen überhaupt zusammen? Unser Skelett ist nicht nur die allgemeine Stütze des Körpers, unsere Knochen fungieren wie oben erwähnt auch als Ansatzstellen der Muskulatur. Und wenn ein Muskel aktiv ist, gehen natürlich Kräfte von ihm aus, denen der jeweilige Knochen standhalten muss. Wobei ein kräftiger Knochen mehr aushalten kann als ein dünner Knochen. Klingt logisch und wurde auch im 19. Jahrhundert schon verstanden.10,11
Auch im Schädel dürften also die Knochen nicht überall gleich kräftig sein. Sie sind nur da kräftig, wo es auch wirklich benötigt wird. Für das Knochenwachstum verbraucht ein Körper Ressourcen. Die stark beanspruchten Stellen werden verstärkt, während bei anderen Stellen gespart werden kann.12 Diese Abwechslung an kräftigen und weniger kräftigen Stellen im Schädel könnte man auch als ein „Netzwerk aus Stresslinien“ bezeichnen.13
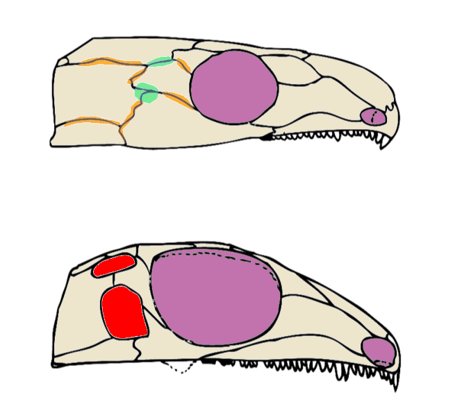
Denkt man das zu Ende, könnte sich im Lauf der Zeit das Knochenwachstum mehr und mehr an den „Stresslinien“ konzentriert haben, während an den „Schwachstellen“ immer weniger Knochengewebe produziert wurde bis es letztendlich gar nicht mehr dazu kam. Das Ergebnis: Schläfenöffnungen (Abb. 4).
Hierbei muss man auch verstehen, dass sich Schläfenöffnungen nie innerhalb eines Knochens, sondern immer zwischen den einzelnen Schädelknochen befinden. Die Öffnungen sind also nicht einfach Löcher im Schädel, sondern eine Lücke zwischen einzelnen Schädelknochen, die nicht komplett aufeinander zugewachsen sind.
Schwachstellen und zusätzliche Öffungen
Soweit die Theorie, aber lassen sich dafür auch Hinweise finden? Ich denke ja. Schon im vorherigen Jahrhundert wurden entsprechende Beobachtungen an frühen Amnioten und anderen Tetrapoden als Erklärung für die Evolution von Schläfenöffnungen herangezogen. Bei frühen Synapsiden der Familie Ophiacodontidae, die für Synapsiden typisch meist nur ein Paar Schläfenöffnungen haben, kann gelegentlich ein zweites Paar auftreten. Manchmal auch nur auf einer Seite des Schädels (Abb. 5).14,15 Die jeweilige Stelle soll, wenn keine Öffnung vorhanden ist, dünn wie Papier sein. Also ein möglicher Hinweis, dass wir hier eine „Schwachstelle“ haben.16
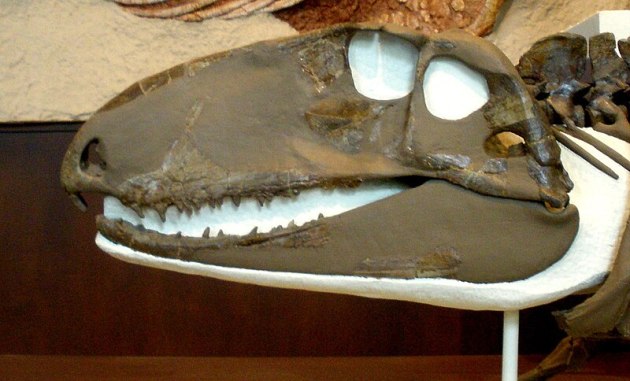
Eine ähnliche Hypothese hatte Fox (1964) für den bereits erwähnten Captorhinus aufgestellt.17 Demnach soll sich in der „Wange“ von Captorhinus, am Treffpunkt der Knochen Jugale, Squamosum und Postorbitale (vgl. Abb. 1 und 4) eine dünne Stelle befinden, die eine „Vorstufe“ einer Schläfenöffnung sein könnte. Das haben wir uns in einem Paper näher angesehen, aber mehr dazu in Teil 3.
Selbst bei einem möglicherweise entfernten Verwandten der Amnioten, Gephyrostegus bohemicus, hatte Jaekel (1902) „Vorstufen“ von zwei Paar Schläfenöffnungen vermutet.18 Es könnte also tatsächlich relativ einfach sein in einem geschlossenen Schädelpanzer Schläfenöffnungen auszubilden.
Warum diese plötzliche Vielfalt?
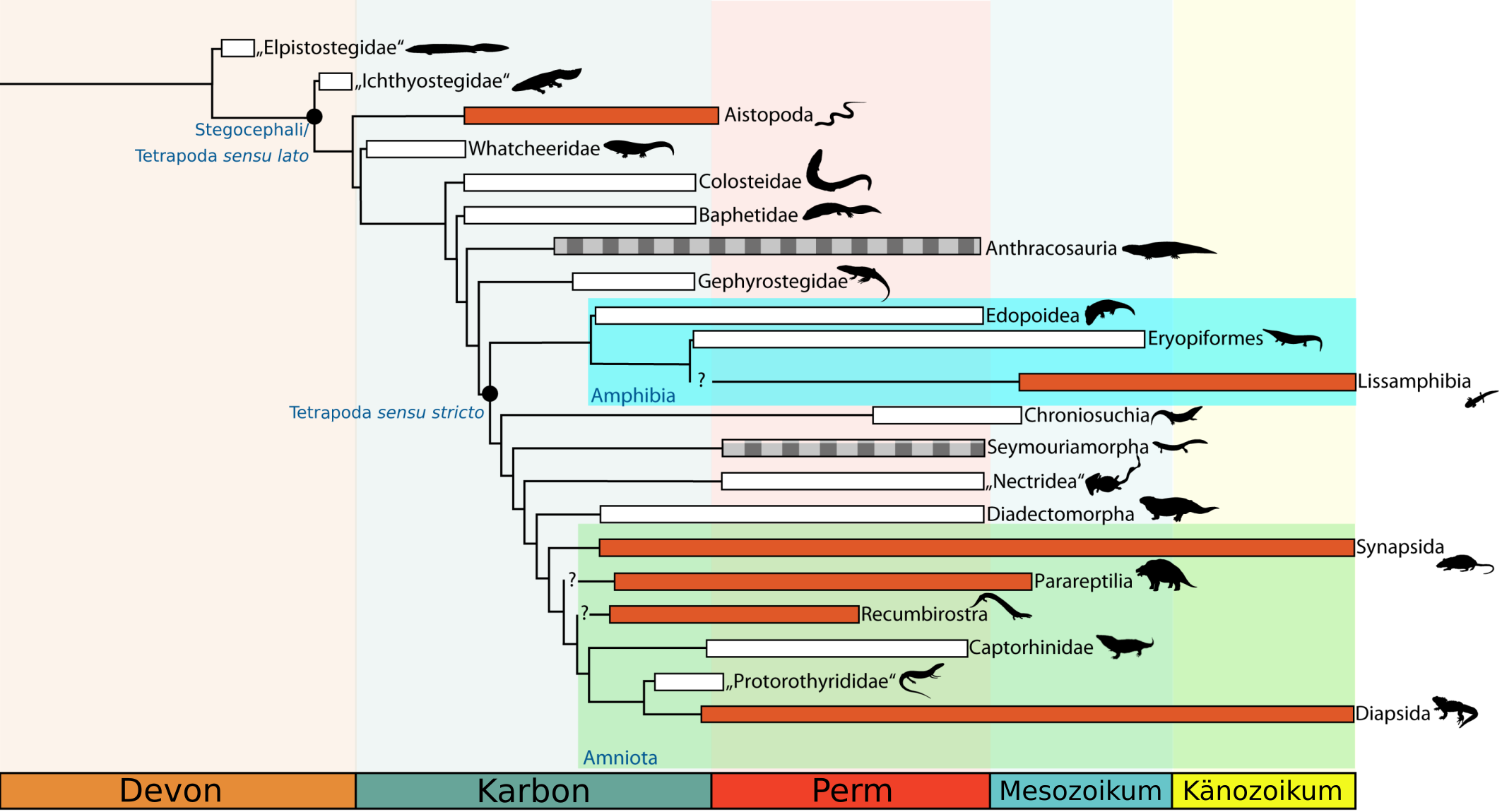
Dennoch hat es noch einige Zeit gedauert bis die Sache mit den Schläfenöffnungen wirklich durchgestartet ist. Sehen wir uns dazu oben noch einmal Abb. 2 an. Ja, vereinzelte Gruppen mit Schläfenöffnungen gab es schon relativ früh, aber wirklich häufig und auch vielfältig wurden sie erst ab der Mitte des Karbons, etwa 50 Millionen Jahren nach dem Auftreten der ersten Tetrapoden (Abb. 6).
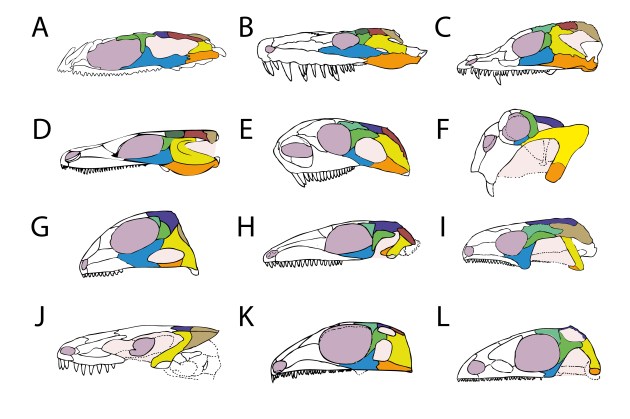
Aus Abel & Werneburg (2024). Schädelzeichnungen (A-L) nach Pardo et al. (2017), Panchen (1977), Reisz et al. (2009), Klembara et al. (2007), Romer & Price (1940), Ray (2005), Broom (1913), Gow (1972), Bolt & Rieppel (2009), Pardo et al. (2016), Reisz (1977), Carroll (1981).
Was ist hier geschehen? Ein Blick in Abb. 2 macht deutlich, dass die plötzliche Evolution der Schläfenöffnungen mit dem Auftreten der Amnioten zusammenhängt. Während sich Beine und Lungen schon im Devon entwickelt haben, waren die meisten frühen Tetrapoden noch an ein zumindest teilweises Leben im Wasser gebunden.
Die Amnioten dagegen waren wahrscheinlich die erste Wirbeltiergruppe, die ihr Leben komplett an Land verbringen konnte. Dazu bedurfte es mehrerer Anpassungen, nicht nur bei der Entwicklung des namensgebenden amniotischen Eis (Abb. 7), sondern auch bei Körperbau, Stoffwechsel, Sinnesorgane und: dem Fressen.19
Frühe im Wasser lebende Tetrapoden haben wie Fische ihre Nahrung wohl „aufgesaugt“. Heißt, durch schnelle Kieferbewegungen wird ein Unterdruck erzeugt, der die Nahrung in das Maul befördert, wobei insbesondere die inneren Kieferadduktoren eine größere Rolle spielen. Das ist an Land nicht mehr möglich. Hier haben sich, vielleicht auch durch andere Anpassungen wie einem beweglichen Kopfgelenk,20 komplexere Kieferbewegungen entwickelt, die vor allem eine Vergrößerung der äußeren Kieferadduktoren (vgl. Abb. 3) benötigten.13

Hier kommt jetzt auch wieder unser „Stressnetzwerk“ ins Spiel, das durch die größere Rolle der äußeren Kieferadduktoren dann vielleicht auch eher zur Bildung von Schläfenöffnungen geführt hat. Gleichzeitig dürfte es durch diese komplett neue Lebensweise ohne Wasserbindung auch eine sogenannte adaptive Radiation gegeben haben. Heißt, aus Mangel an Konkurrenz haben die Amnioten schnell verschiedene ökologische Nischen erschlossen. Wir haben relativ früh direkt große bullige Pflanzenfresser, flinke Insektenfresser und große Landräuber.21,22
Verschiedene Arten des Fressens stellen unterschiedliche Ansprüche an die Kiefer und ihre Muskulatur. Entsprechend ist auch das „Stressnetzwerk“ immer ein bisschen anders augeprägt, also auch die Schwachstellen, die potentiell eine Schläfenöffnungen bilden könnten.23 Ein Vorteil könnte hier auch das amniotische Ei gewesen sein. Haben frühe Tetrapoden ihr Leben als Larve im Wasser begonnen und später wie heutige Amphibien eine Verwandlung zum erwachsenen Tier durchlaufen, überspringen Amnioten dieses Larvenstadium und wachsen direkt im Ei zum „fertigen“ Tier heran. Das könnte den Muskeln in ihrer frühen Entwicklung mehr Spielraum in ihrer Art der Knochenverankerung geben bevor sie dann endgültig „gebraucht“ werden.24
Die einzige Erklärung?
Wäre hiermit das Rätsel der Schläfenöffnungen gelöst? Wahrscheinlich nicht. Wie so oft in der Natur wird es mehrere Faktoren geben, die die Evolution von Schläfenöffnungen beeinflussen und je nach Tierart spielt mal der eine oder der andere Faktor eine größere Rolle. Weiter oben wurden bereits das Kiefergelenk und das Gehör erwähnt. Andere Faktoren könnte die Beweglichkeit innerhalb des Schädels,25 die allgemeine Gewichtsreduktion17 oder das Vorhandensein äußerer Drücke unterwasser oder beim Graben sein.27
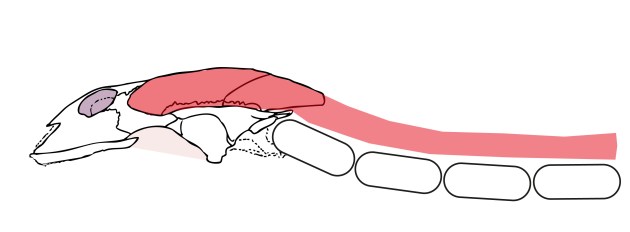
Wichtig könnte auch der Einfluss der Halsmuskeln sein (Abb. 8). Das dürfte besonders auf die Schildkröten zutreffen. In Teil 1 hatten wir noch gelernt, dass die ersten Schildkröten von Arten mit Schläfenöffnungen abstammen, diese aber wieder geschlossen hatten. Das ist aber nicht das gesamte Bild. Bis auf ein paar wenige Ausnahmen, haben heutige Schildkröten wieder Schläfenöffnungen, wenn auch nicht die typischen „Fenster“, sondern große Einbuchtungen.28
Das könnte mit der Evolution des Schildkrötenpanzers zusammenhängen und ihrer Fähigkeit ihren Hals in diesen zurückzuziehen.29 Die großen Einbuchtungen dienen hierbei als Ansatzstellen der Halsmuskulatur und variieren je nachdem ob es sich um Halswender- (Kopf wird zur Seite hin eingezogen) oder Halsberger-Schildkröten (Kopf wird auf gerader Linie nach hinten gezogen) handelt.30
Wir haben uns hier auch bis jetzt vor allem auf die Amnioten konzentiert. Nicht vergessen dürfen wir, dass auch die heutigen Amphibien ihren „Dachschädel“ stark reduziert haben.31 Manche Salamander haben ein oberes Paar Schläfenfenster, das an das der Diapsiden erinnert.32 Viele Froschlurche zeigen außerdem seitliche Schläfenöffnungen, nicht unähnlich denen der Synapsiden (Abb. 9). Nur, dass es hier nicht an der Reduktion von Knochen liegt, sondern weil sich der normalerweise stark reduzierte Froschschädel wieder neu verknöchert hat („Hyperossifizierung“). Während sich manchmal wieder ein „Dachschädel“ bildet, können in anderen Fällen die erwähnten Öffnungen bestehen bleiben. Ein Zusammenhang mit der hohen Beißkraft dieser Frösche ist naheliegend.33 Zuletzt haben sich auch bei den Blindwühlen mit ihrem „Dachschädel“ mehrmals unabhängig voneinander Schläfenöffnungen entwickelt.34

Hier passt unsere Erklärung mit dem amniotischen Ei nicht mehr. Nichtdestotrotz könnten hier wieder eine Vergrößerung der Kieferadduktoren ein Grund für den Verlust des „Dachschädels“ sein.35
Damit auch nicht erklären lässt sich wohl der für frühe Tetrapoden hochspezialisierte Schädel der Aistopoda (vgl. Abb. 2 & 6A) oder die kleine Schläfenöffnung bei Anthracosaurus russelli (vgl Abb. 6B). Bei den Recumbirostra (vgl. Abb. 6I,J) wäre es davon abhängig, wo sie im Stammbaum der Tetrapoden stehen. Handelt es sich bei ihnen um frühe Amnioten wie manche neuere Studien argumentieren36,37, wären die großen Schläfeneinbuchtungen nicht sonderlich überraschend. Stehen sie allerdings außerhalb der Amnioten, hätten wir einen weiteren Fall, wo sich derartige Öffnungen unabhängig vom Landgang der Amnioten gebildet haben.
Alles in allem ist die Evolution der Schläfenöffnungen eine komplexe Angelegenheit. Weder lassen sich Tetrapoden anhand ihrer Öffnungen eindeutig in Verwandtschafftsgruppen unterteilen (siehe Teil 1), noch gibt es die eine Antwort zur Entstehung von Schläfenöffnungen (siehe dieser Teil).
Im dritten und letzten Teil werden wir uns ansehen, ob sich potentielle Schwachstellen im „Dachschädel“ des frühen Amnioten Captorhinus finden lassen.
Weiterführende Literatur
- Abel, P. und Werneburg, I. (2021). Morphology of the temporal skull region in tetrapods: research history, functional explanations, and a new comprehensive classification scheme. Biological Reviews 96 (5): 2229–2257. doi: 10.1111/brv.12751
- Abel, P. und Werneburg, I. (2024). The temporal region of the tetrapod skull: a textbook example on integrative morphology. Revue de Paléobiologie. https://www.researchgate.net/publication/378971484_The_temporal_region_of_the_tetrapod_skull_a_textbook_example_on_integrative_morphology
- Werneburg, I. (2013). The tendinous framework in the temporal skull region of turtles and considerations about its morphological implications in amniotes: a review. Zoological Science 30(3), 141–153. doi: 10.2108/zsj.30.141
- Werneburg, I. (2019). Morphofunctional categories and ontogenetic origin of temporal skull openings in amniotes. Frontiers in Earth Science 7, 1–7. doi: 10.3389/feart.2019.00013
Andere erwähnte Referenzen
- Bolt, J. R., & Rieppel, O. (2009). The holotype skull of Llistrofus pricei Carroll and Gaskill, 1978 (Microsauria: Hapsidopareiontidae). Journal of Paleontology, 83(3), 471-483. doi: 10.1666/08-076.1
- Broom, R. (1913). On the structure and affinities of Bolosaurus. Bulletin American Museum of Natural History 32(33), 509–516. https://digitallibrary.amnh.org/items/00647dfb-c072-4875-bb88-7c85b09e91dc
- Carroll, R. L. (1981). Plesiosaur ancestors from the Upper Permian of Madagascar. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 293(1066), 315-383. doi: 10.1098/rstb.1981.0079
- Ferreira, G. S., & Werneburg, I. (2019). Evolution, diversity, and development of the craniocervical system in turtles with special reference to jaw musculature. Heads, Jaws, and Muscles: Anatomical, Functional, and Developmental Diversity in Chordate Evolution, 171-206. doi: 10.1007/978-3-319-93560-7_8
- Fox, R. C. (1964). The adductor muscles of the jaw in some primitive reptiles. Univ. Kan. Publ. 12, 657–680. https://www.gutenberg.org/files/30321/30321-h/30321-h.htm
- Fox, R. C. & Bowman, M. C. (1966). Osteology and relationships of Captorhinus aguti (Cope) (Reptilia: Captorhinomorpha). The University of Kansas Paleontological Contributions Vertebrata 11, 1–79. https://www.semanticscholar.org/paper/Osteology-and-relationships-of-Captorhinus-aguti-Fox-Bowman/0fe77983215c9c01c52a77b94ad6f8460c978135
- Gow, C. E. (1972). The osteology and relationships of the Millerettidae (Reptilia: Cotylosauria). Journal of Zoology, 167(2), 219-264. doi: 10.1111/j.1469-7998.1972.tb01731.x
- Jaekel, O. (1902). Ueber Gephyrostegus bohemicus. Z. Dtsch. Geol. Ges. 54, 127–133. https://www.biodiversitylibrary.org/item/150077#page/967/mode/1up
- Klembara, J., Berman, D. S., Henrici, A. C., Čerňanský, A., Werneburg, R., & Martens, T. (2007). First description of skull of Lower Permian Seymouria sanjuanensis (Seymouriamorpha: Seymouriidae) at an early juvenile growth stage. Annals of Carnegie Museum, 76(1), 53-72. doi: 10.2992/0097-4463(2007)76[53:FDOSOL]2.0.CO;2
- Ogushi, K. (1911). Anatomische Studien an der japanischen dreikralligen Lippenschildkrote (Trionyx japonicus). Gegenbaurs Morphologisches Jahrbuch 43, 1–106. https://books.google.de/books/about/Anatomische_Studien_an_der_japanischen_d.html?id=-QJPYAAACAAJ&redir_esc=y
- Panchen, A. L. (1977). On Anthracosaurus russelli Huxley (Amphibia: Labyrinthodontia) and the family Anthracosauridae. Philosophical Transactions of the Royal Society of London. B, Biological Sciences, 279(968), 447-512. doi: 10.1098/rstb.1977.0096
- Pardo, J. D., & Anderson, J. S. (2016). Cranial morphology of the Carboniferous-Permian tetrapod Brachydectes newberryi (Lepospondyli, Lysorophia): new data from µCT. PloS one, 11(8), e0161823. doi: 10.1371/journal.pone.0161823
- Pardo, J. D., Szostakiwskyj, M., Ahlberg, P. E., & Anderson, J. S. (2017). Hidden morphological diversity among early tetrapods. Nature, 546(7660), 642-645. doi: 10.1038/nature22966
- Ray, S. (2005). Lystrosaurus (Therapsida, Dicynodontia) from India: taxonomy, relative growth and cranial dimorphism. Journal of Systematic Palaeontology, 3(2), 203-221. doi: 10.1017/S1477201905001574
- Reisz, R. R. (1977). Petrolacosaurus, the oldest known diapsid reptile. Science, 196(4294), 1091-1093. doi: 10.1126/science.196.4294.109
- Reisz, R. R., Schoch, R. R., & Anderson, J. S. (2009). The armoured dissorophid Cacops from the Early Permian of Oklahoma and the exploitation of the terrestrial realm by amphibians. Naturwissenschaften, 96, 789-796. doi: 10.1007/s00114-009-0533-x
- Romer, A. S., & Price, L. I. (1940). Review of the Pelycosauria (Vol. 28). Geological Society of America. https://books.google.de/books/about/Review_of_the_Pelycosauria.html?id=2h_rxwEACAAJ&redir_esc=y
- Smithson, T. R. (1985). The morphology and relationships of the Carboniferous amphibian Eoherpeton watsoni Panchen. Zoological Journal of the Linnean Society, 85(4), 317-410. doi: 10.1111/j.1096-3642.1985.tb01517.x